注目研究の紹介 2022年5月
本学の注目研究を毎月1つずつ紹介します。
※最新の注目研究や他のバックナンバーはこちら
疾患治療のための自己組織化ペプチドナノファイバーの開発
両親媒性分子は、ミセル、ベシクル、チューブ、ファイバー、および単分子膜などさまざまな形態のナノ構造体へと自己組織化することが知られています。私たちの研究室では、このような自己組織化能をもつ分子を、生理活性分子を集積化させるためのツールとして用いて、疾患治療への応用を指向した様々な機能性ナノファイバーの開発に取り組んでいます。
ペプチドナノファイバーによるペプチドワクチンのデリバリー
がんペプチドワクチン療法は、患者への負担や副作用が小さいことから、抗がん剤治療や外科手術などの従来法に代わる新たながん治療法として注目されています。がん治療に有効な免疫を誘導するためには、キラーT細胞と呼ばれる免疫の担い手となる細胞がワクチン投与により活性化されることが重要です。しかし、ワクチンとして機能する抗原ペプチドのみを投与した場合には、キラーT細胞を十分に活性化させることはできません。これは、投与した抗原ペプチドが、キラーT細胞を活性化するための細胞 (樹状細胞)の中に取り込まれる効率が低いことが一因です。そのため、抗原ペプチドを樹状細胞に効率よく送達するためのデリバリーシステムの開発が求められています(図1)。
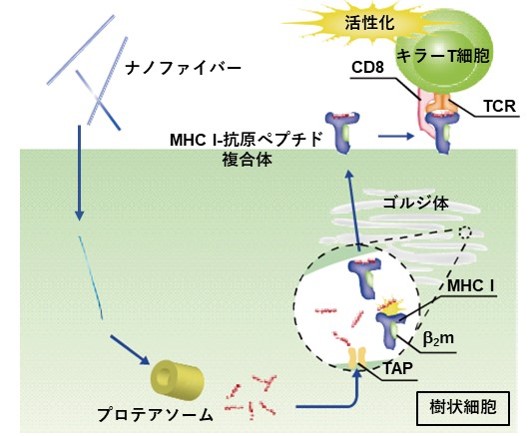
図1 自己組織化ペプチドナノファイバーによる抗原ペプチドの樹状細胞へのデリバリー:
細胞取り込みの促進および細胞内動態の制御によりキラーT細胞の活性化を促進する。
これまでに、リポソームや高分子ナノ粒子などの分子集合体をキャリアに用いたデリバリーシステムが報告されていますが、抗原ペプチドのキャリアへの担持効率が低いことや調製方法が煩雑であることなどの問題点がありました。この問題を解決するために、我々の研究室では、βシートペプチドと呼ばれる分子が水中で自己組織化することにより形成するナノファイバーに着目し、これを用いた抗原デリバリーシステムの開発に取り組んでいます。βシートペプチドに抗原ペプチドを結合させると、この分子の水溶液を加熱することにより、抗原を高効率に担持したナノファイバーを簡便に作製することができます (図2)。また、ペプチドナノファイバーは高秩序な規則構造を有するため、分子設計によるナノファイバーの機能化が可能です。

図2 (a) ビルディングブロック分子の設計
(b) 自己組織化による抗原を高効率に担持したペプチドナノファイバーの作製
これまでの研究では、親・疎水性バランスやナノファイバーの長さなどの構造の違いが、細胞取り込み効率や細胞毒性などの性質にどのような影響を与えるのかを詳細に調べることで、デリバリー材料としての分子設計の最適化を図ってきました(図3)。キラーT細胞の活性化のためには、抗原ペプチドを樹状細胞内に送達するだけでなく、細胞内での動態をも制御する必要があります。現在、狙いとする細胞内の場所に抗原ペプチドを届けるために、細胞内の環境に応答して性質を変化させることのできる機能性ペプチドナノファイバーの開発に取り組んでいます。

図3 (a) 抗原を担持したペプチドナノファイバーの透過型電子顕微鏡画像
(b) ペプチドナノファイバーを取り込んだ樹状細胞の共焦点レーザー顕微鏡画像
ペプチドナノファイバーによるアルツハイマー病原因タンパク質の異常凝集抑制
アルツハイマー病は、脳内でアミロイドβ (Aβ) と呼ばれるたんぱく質が異常凝集することによって引き起こされると考えられています。そのため、脳内のAβの異常凝集抑制はアルツハイマー病の治療に有効なアプローチのひとつとして期待されています。ナノ材料は大きな比表面積を有するため、その表面を適切に設計することによりAβを効率よく吸着し、その凝集を抑制することが可能になります。私たちの研究室では、ナノ材料を用いたAβの凝集抑制に取り組んでいます。これまでに、脳内への移行性をもつペプチドとAβ凝集抑制能をもつペプチドの二種類の分子を構成成分とするナノファイバーを開発しました (図4)。このナノファイバーは、in vitroにおいてAβの凝集を抑制するとともに、鼻粘膜経路および静脈経路で投与した際に脳内へと移行することが確認されました (図5)。さらに、モリス水迷路試験と呼ばれる実験法によりアルツハイマー病のモデルマウスの認知機能を評価したところ、ナノファイバーを投与することによる認知機能の改善が認められました (図6)。生体内でのAβの凝集を抑制するためには、生体内に存在する他のタンパク質のナノ材料表面への吸着や、ナノ材料自身の凝集を抑制することが重要です。現在は、このことを念頭においた分子設計により、より効率よくAβの凝集を抑制するナノ材料の開発に取り組んでいます。
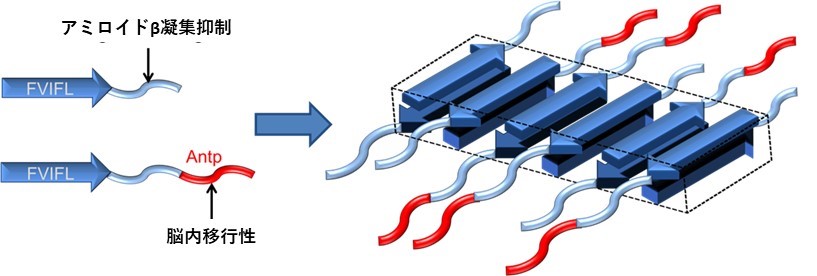
図4 二種類のペプチドの共集合によるナノファイバーの作製
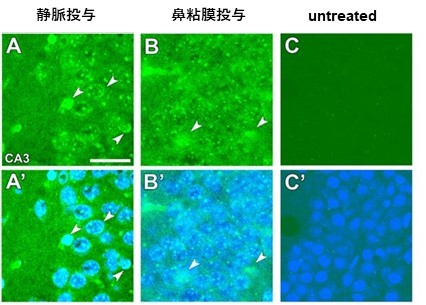
図5 ナノファイバー投与後のマウス海馬の共焦点レーザー顕微鏡画像:
ナノファイバーは緑色に、ニューロンの核は青色それぞれに染色されている。
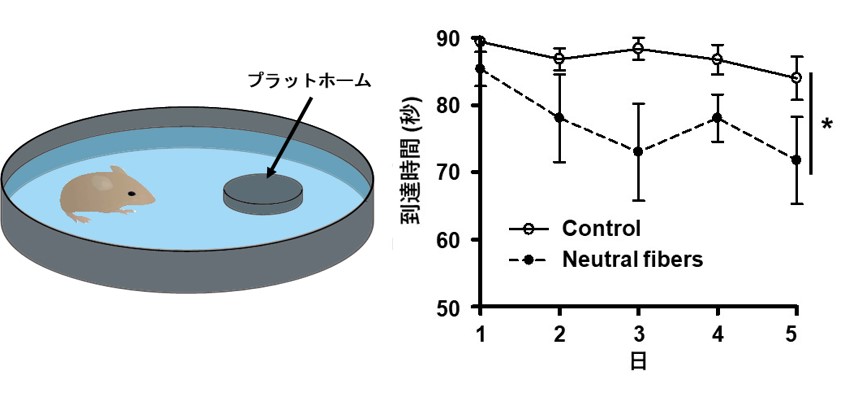
図6 モリス水迷路試験によるアルツハイマーモデルマウスの認知機能評価:
マウスをプールで泳がせ、ゴール (プラットフォーム) に到達するまでにかかる時間を日ごとに測定した。
ナノファイバー投与群では、到達に要する時間の短縮が確認された。
【主な発表論文】
- Investigation on the Interactions between Self-Assembled β-Sheet Peptide Nanofibers and Model Cell Membranes. Waku T., Kasai Y., Kobori A., Tanaka N., Int. J. Mol. Sci. 21, 9518 (2020), DOI: 10.3390/ijms21249518.
- Development of a brain-permeable peptide nanofiber that prevents aggregation of Alzheimer pathogenic proteins. Tanaka N., Kobayashi Y., Uemura T., Tsuchiya N., Nishigaki T., Kumo S., Okuda M., Sugimoto H., Miyata S., Waku T., PLoS One 15, e0235979 (2020), DOI: 10.1371/journal.pone.0235979.
- Modulation of cell adhesion and differentiation on collagen gels by the addition of the ovalbumin secretory signal peptide. Kojima C., Narita Y., Nakajima N., Morimoto N., Yoshikawa T., Takahashi N., Handa, A., Waku T., Tanaka N., ACS Biomater. Sci. Eng. 5, p.2698-5704 (2019), DOI: 10.1021/acsbiomaterials.8b01505.
- Effect of the hydrophilic-hydrophobic balance of antigen-loaded peptide nanofibers on their cellular uptake, cellular toxicity and immune stimulatory properties. Waku T., Nishigaki S., Kitagawa Y., Koeda S., Kawabata K., Kunugi S., Kobori A., Tanaka N., Int. J. Mol. Sci. 20, 3781 (2019), DOI: 10.3390/ijms20153781.
※最新の注目研究や他のバックナンバーはこちら
