分子化学系 田嶋邦彦教授らの研究グループは、酵素のより原始的な祖先の姿を明らかにしました
分子化学系 田嶋邦彦教授、櫻井康博研究員、愛媛大学大学院農学研究科(沿岸環境科学研究センター教授 兼任)渡辺誠也教授、同修士課程2年生(当時;現 天野エンザイム株式会社所属)村瀬陽介さん、同助教(当時;現 山形大学理学部講師)渡邊康紀さんの研究グループは、アコニターゼファミリーのタンパク質の中で唯一機能が不明だったアコニターゼXにおいて、最近その基質が明らかとなったシス-3-ヒドロキシ-L-プロリン脱水酵素とメバロン酸5-リン酸脱水酵素の立体構造を、X線結晶回折法により世界で初めて明らかにしました。
アコニターゼXを除くアコニターゼファミリーに属する全てのメンバーは、祖先型遺伝子が重複しその後基質特異性が向上するという“酵素進化のリクルート仮説”で説明できる典型例とされてきました。今回決定されたアコニターゼXの全体構造はこれら既知のメンバーと一部似ていましたが、活性中心に含まれる鉄硫黄クラスターや基質の結合様式は大きく異なっていました。こうした事実は、いままで考えられていたものよりさらに原始的な共通祖先の存在を連想させ、アコニターゼファミリーを含むタンパク質の分子進化に新たな知見を与えると期待されます。
本件の詳しい内容はこちら(PDF)
※本研究結果は『Communications Biology』(外部サイト)に掲載されました。
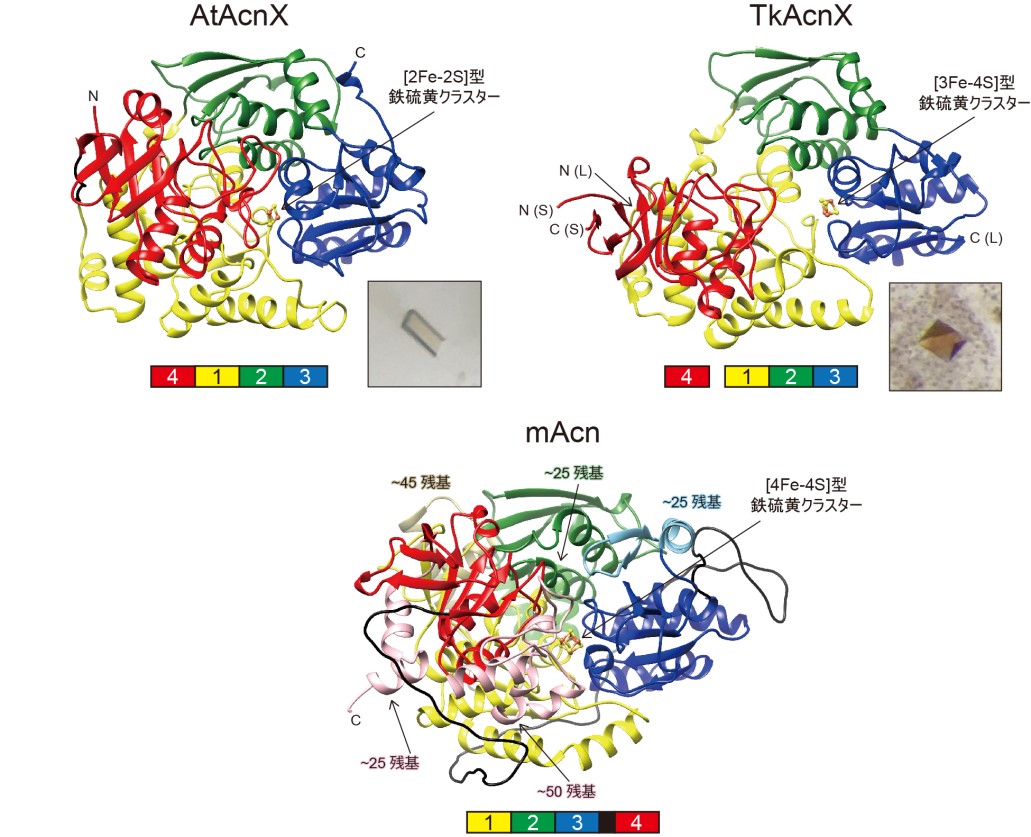
図:AtAcnXとTkAcnXの立体構造とmAcnとの比較
